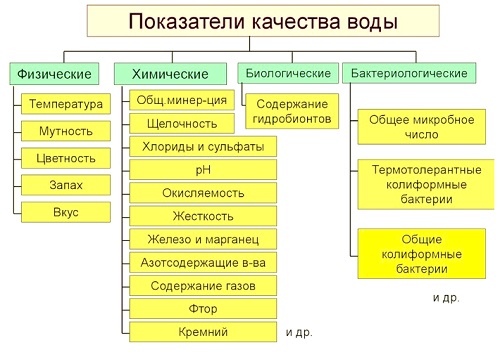
 Основные показатели качества воды
Основные показатели качества воды
Мутность — показатель качества воды, определяемый мутномером Бейлиса путем сравнения исследуемой воды с соответствующим образом подготовленными образцами. В качестве единицы мутности принята такая мутность, которая возникает при добавлении 1 мг суспензии кизельгура или каолина в 1 дм3 дистиллированной воды.
Цветность — показатель качества воды, выражаемый в единицах цветности, то есть в градусах платиново-кобальтовой шкалы (1° соответствует цветности, которую дает 1 мг соли Pt, растворенной в 1 дм3 воды). Цветность воды вызывается присутствием цветных веществ, попадающих в воду вместе со сточными водами, органическими веществами из почвы, соединениями железа, коллоидами или цветением.
Запах — показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха; устанавливается в холодном или горячем состоянии; сила запаха указывается по 5-балльной шкале:
0 — нет запаха;
1 — очень слабый запах;
2 — слабый запах;
3 — выразительный запах;
4 — сильный запах;
5 — очень сильный запах.
Следует также дополнительно указывать группу запаха по следующей классификации:
R — запахи естественного растительного проис-хождения, вызванные органическими соединениями, которые не находятся в состоянии гнилостного разложения (например: запах земли, мха, сена, торфа, древесной коры, запах цветов и т. п.);
G — гнилостные запахи естественного происхождения, вызванные присутствием в воде органических веществ, находящихся в состоянии гнилостного разложения (например: затхлый запах, прелый запах, запах плесени, тухлых яиц, фекальный и т. п.);
S — запахи неестественного происхождения, специфические, вызванные присутствием соединений, не встречающихся в природной воде, — фенола, нефтепродуктов, хлора и т. п.
Показатель рН - выражает степень кислотности или щелочности воды и количественно определяется
концентрацией ионов водорода рН = - lg [H+]
Определение pH выполняется колориметрическим или электрометрическим методом. Вода с низкой реакцией рН отличается коррозионностью, вода же с высокой реакцией рН проявляет склонность к вспениванию.
 Общая (полная) жесткость — свойство, вызванное присутствием растворенных в воде веществ - в основном солей кальция и магния (а также других катионов, которые выступают, однако, в значительно меньших количествах, таких как ионы: железа, алюминия, марганца и тяжелых металлов). Жесткость воды определяется содержанием растворенных в ней солей калия и магния, выраженных в мг-экв/дм3 (1 мг Ca2+/дм3 соответствует 0,05 мг-экв/дм3, а 1 мг Mg2+/дм3 — 0,082 мг-экв/дм3). Общая жесткость классифицируется по катионам (кальциевая жесткость и магниевая жесткость) или по анионам (карбонатная и некарбонатная жесткость). Общая жесткость - это сумма карбонатной и некарбонатной жесткости или сумма кальциевой и магниевой жесткости.
Общая (полная) жесткость — свойство, вызванное присутствием растворенных в воде веществ - в основном солей кальция и магния (а также других катионов, которые выступают, однако, в значительно меньших количествах, таких как ионы: железа, алюминия, марганца и тяжелых металлов). Жесткость воды определяется содержанием растворенных в ней солей калия и магния, выраженных в мг-экв/дм3 (1 мг Ca2+/дм3 соответствует 0,05 мг-экв/дм3, а 1 мг Mg2+/дм3 — 0,082 мг-экв/дм3). Общая жесткость классифицируется по катионам (кальциевая жесткость и магниевая жесткость) или по анионам (карбонатная и некарбонатная жесткость). Общая жесткость - это сумма карбонатной и некарбонатной жесткости или сумма кальциевой и магниевой жесткости.
Карбонатная жесткость (временная) — вызвана присутствием растворенных в воде бикарбонатов, карбонатов и углеводородов кальция и магния. При нагревании бикарбонаты кальция и магния частично выпадают из раствора в результате обратимых реакций разложения и гидролиза. В результате этих реакций жесткость снижается.
Некарбонатная жесткость (постоянная) — вызвана присутствием растворенных в воде хлоридов, сульфатов и силикатов кальция и магния (не растворяются и не выпадают в осадок из растворенного состояния при нагревании воды).
Щелочность (основность) — индикатор, определяющий содержание гидроокисей, бикарбонатов и карбонатов щелочных металлов (Na, K) и щелочноземельных металлов (Ca, Мg). Щелочность воды определяется в мг-экв/дм3 и определяется, титрованием 100 см3 воды 0,1-нормальным раствором соляной или серной кислоты по фенолфталеину (щелочность „p”), а затем по метилоранжу (щелочность „m”). Щелочность „p” (изменение цвета при pH = 8,2) учитывает все щелочно-реагирующие составляющие воды, которые диссоциируют с выделением ионов OH-, а щелочность „m” (изменение цвета при pH = 4,3) отображает содержащиеся в воде соединения, вступающие в реакцию с соляной кислотой до получения точки нейтрализации по метилоранжу.
Железо, марганец — в натуральной воде выступают преимущественно в виде углеводородов, сульфатов, хлоридов, гумусовых соединений и иногда фосфатов. Присутствие ионов железа и марганца очень вредит большинству технологических процессов, особенно в целлюлозной, текстильной промышленности и производстве фотопленок. Кроме того, содержание железа и марганца в воде может вызывать развитие марганцевых бактерий и железобактерий, колонии которых могут быть причиной зарастания водопроводных сетей.
Хлориды — присутствие хлоридов в воде может быть вызвано вымыванием грунтовыми водами залежей хлоридов или же они могут в ней появится вследствие попадания стоков. Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем всегда в виде растворенных соединений.
Соединения азота (аммиак, нитриты, нитраты) — возникают, главным образом, из белковых соединений, которые попадают в воду вместе со сточными водами. Аммиак, присутствующий в воде, может быть органического или неорганического происхождения. В случае органического происхождения наблюдается повышенная окисляемость. Нитриты возникают, главным образом, вследствие окисления аммиака в воде, могут также проникать в нее вместе с дождевой водой вследствие растворения нитратов почвы.
 Нитраты - это продукт биохимического окисления аммиака и нитритов, или же они могут быть выщелочены из почвы.
Нитраты - это продукт биохимического окисления аммиака и нитритов, или же они могут быть выщелочены из почвы.
Сероводород — придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, в каком виде проявляется сероводород, зависит от реакции pH:
- при pH < 5 имеет вид H2S;
- при pH > 7 выступает в виде иона HS-;
- при pH = 5-7 может быть в виде, как H2S, так и HS-.
Сульфаты — наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они проникают в нее вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы — продуктов распада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода — в зависимости от реакции pH воды может быть в следующих видах:
- при pH < 4,0 – в основном, как газ CO2;
- при pH = 8,4 – в основном в виде иона бикарбоната НСО3- ;
- при pH > 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода — это часть свободной двуокиси углерода, которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей. При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание соли в воде. Вода с одинаковым содержанием агрессивного CO2, тем агрессивнее, чем выше ее солесодержание.
Окисляемость — условный показатель качества воды, определяющий содержание в воде веществ, окисляющихся перманганатом калия KMnO4 и выраженный в мг O2/дм3 исследованной воды или в мг использованного KMnO4 на дм3 (1 мг KMnO4 соответствует 0,25 мг O2).
Сухой остаток — это остаток после испарения воды, высушенный при температуре 105°C и пересчитанный на 1 дм3 воды. Состоит из всех постоянных, растворенных и суспендированных веществ в воде.
Остаток после прокаливания — это остаток после прокаливания сухого остатка при температуре 550°C (выжигаются все органические вещества).
Потери после прокаливания — условный показатель содержания органических соединений в воде.
Электропроводность — вызывается присутствием ионов, возникших в результате диссоциации растворенных солей, а также аммиака и двуокиси углерода. Единицей проводимости является S/cм (µS/cм). Электропроводность следует определять при температуре 20°C. Может служить основанием для оценки общего солесодержания по условной концентрации NaCl согласно зависимости: 1 µS/см = 0,55 мг NaCl/дм3.
Мы уже много лет продаем и устанавливаем фильтры питьевой воды по всей Украине и искренне верим в свое дело. То, что фильтры способны обеспечивать Вас качественной водой - перепроверено многократно. Если у Вас есть вопросы по финансовой части, предлагаем статью со сравнительным расчетом заказа бутиллированной воды, или фильтра - вы удивитесь!